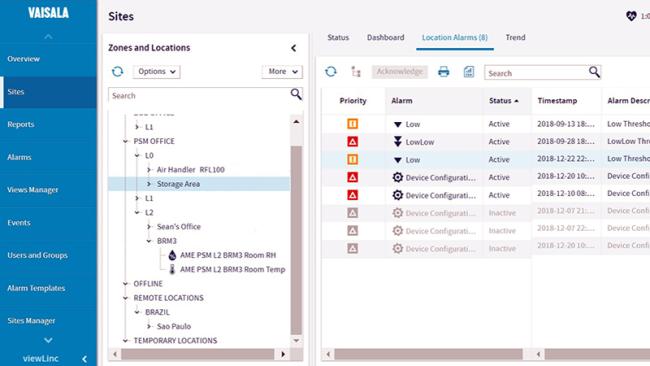
Qualifizierung des Umgebungsmappings
Mit umfassenden Mappingqualifizierungslösungen unterstützt Sie Vaisala bei der Einhaltung von Leitlinien für gute Vertriebspraxis wie EU GDP (2013/C 343/01) oder USP 36, Chapter 1079 sowie das noch ausstehende Chapter 1083.
Qualifizierungen des Umgebungsmappings sind in Bereichen vorgeschrieben, wo Humanarzneimittel und zur Anwendung beim Menschen bestimmte Prüfpräparate aufbewahrt werden. Arzneimittelhersteller, Lagereinrichtungen, Großhändler und andere an der GxP-Lieferkette Beteiligte führen die Qualifizierungen durch. Hier finden Sie ein IQOQ-Protokollbeispiel von Vaisala (PDF).
Das Angebot von Vaisala für die Qualifizierung des Umgebungsmappings umfasst:
- Mapping-Kit: Vaisala Datenlogger, vLog Software zur Erfassung der Messdaten und vLog IQOQ-Protokoll zur Validierung der Software gemäß 21 CFR Part 11 und Annex 11
- Mappingservices für Temperatur und Feuchte, um die kritischen Umgebungsdynamiken von Kühlschränken, Gefrierschränken, Kühlräumen, Lagern, Lagerbereichen, Vertriebszentren, Inkubatoren oder Stabilitätskammern zu profilieren.
- Hinweis: Dieser Service wird derzeit in Großbritannien, Europa und Japan angeboten.
- Optionale benutzungsdefinierte Kalibrierpunkte für branchenweit optimale Genauigkeit
Verschärfte Mappingqualifizierungsanforderungen, gestiegene regulatorische Erwartungen
Eine gute Vertriebspraxis hat in den letzten Jahren einen verstärkten regulatorischen Fokus erfahren. Diese Initiative geht vorrangig auf die kanadische Regulierungsbehörde Health Canada (GUI-0069, 2011) zurück, die erste Regulierungsstelle, die auf Temperaturmapping verwiesen hatte. Diese Richtung wurde bald von Aufsichtsbehörden weltweit bekräftigt:
- CDSCO (Central Drugs Standard Control Organization), Indien
- CFDA (China Food and Drug Administration), China
- EMA (European Medicines Agency), Europa
Jede dieser Organisationen hat seither die neuen oder aktualisierten Richtlinien und Dokumente veröffentlicht. Die USA haben dann USP Chapter 1079 „Good Distribution Practices for Drug Products“ aktualisiert. Kurze Zeit später lagen weitere Richtlinien mit spezifischen Anweisungen vor. Die Publikation der International Society for Pharmaceutical Engineering zum Kühlkettenmanagement enthält Hinweise zur Platzierung von Sensoren für die Mappingqualifizierung. Der Technical Report 58 der Parenteral Drug Association erörtert, wie Risikobewertungen in Bezug auf GDP durchgeführt werden. Und das Pharmaceutical Inspection Co-operation Scheme hat eine eigene GDP-Leitlinie in enger Anlehnung an die EU GDP-Vorschriften veröffentlicht. Dies war ein wichtiger Schritt in Richtung globaler Standardisierung, da PIC/S derzeit mehr als 40 Mitgliedsländer hat.
Veränderungen in der Industrie hinsichtlich temperaturgeregelter Lieferkette fordern Leitlinien
Inzwischen haben sich Vertriebsaktivitäten weiterentwickelt, und Vertriebsketten werden zunehmend internationaler. Dies hat jedoch zu einem erhöhten Risiko von Temperaturabweichungen geführt. Eine gut umgesetzte Qualifizierung des Umgebungsmappings ist die ideale Methode zur Bewertung und zum Ausgleich des Risikos von Schwankungen. Was zeichnet aber eine gute Mappingqualifizierung aus? Zunächst sollten immer Studien durchgeführt werden, bevor Arzneimittel in einem Kühlraum, Lager bzw. in temperaturgeregelten Räumen oder Kammern gelagert werden. Mappings sollen unter repräsentativen Bedingungen durchgeführt werden. In der Praxis bedeutet das die Durchführung saisonaler Mappingstudien im Winter und im Sommer. Zudem sollten Mappings im leeren und gefüllten Zustand durchgeführt werden. Nachdem Mappingqualifizierungen für einen Bereich oder eine Kammer durchgeführt wurden, werden die Überwachungssensoren an den Stellen platziert, an denen die meisten Temperaturschwankungen aufgetreten sind – den heißen und kalten Stellen.
Prinzipien der Validierung führen zu zielbasierten Qualifizierungen
Die ultimativen Ziele der Qualifizierung des Umgebungsmappings lassen sich folgendermaßen zusammenfassen:
- Nachweis der Temperaturgleichmäßigkeit (und ggf. Feuchtegleichmäßigkeit)
- Identifizierung ungeeigneter Lagerbereiche
- Bestimmung repräsentativer Überwachungsstellen
Es ist nicht zu vergessen, dass Mappingqualifizierungsstudien nicht auf feste Stellen beschränkt sind. Für temperaturgeregelte Fahrzeuge in der Vertriebskette wird die ursprüngliche Temperaturmappingqualifizierung gemäß den vorstehenden Grundlagen durchgeführt: unter repräsentativen Bedingungen, leer und beladen, wobei bestimmte Bereiche gemäß den Ergebnissen der Studie entweder als Lagerfläche ausgeschlossen oder kontinuierlich überwacht werden.
Weitere Informationen zu den Lösungen, die Vaisala zur Qualifizierung des Umgebungsmappings bietet, finden Sie in unserer Broschüre, oder Sie wenden sich an unser örtliches Servicezentrum.
Ressourcen
- EU GDP (2013/C 343/01) Guidelines of 5 November 2013 on Good Distribution Practice of medicinal products for human use
- USP 36 – Chapter 1179 Good Storage and Distribution Practices for Drug Products
- USP 36 – Chapter 1083 Good Distribution Practices (die Veröffentlichung steht noch aus)
- 21 CRF Part 11 Electronic Records/Electronic Signatures
- EU GMP Annex 11 Computerized systems
- GUI- 0069 Guidelines for Temperature Control of Drug Products during Storage and Transportation, 2011.
- CDSCO Guidelines on Good Distribution practices for biological products, 2012.
- CFDA The Good Supply Practice for Pharmaceutical Products, GSP (China) Order of the Ministry of Health of the People’s Republic of China No. 90, 2013.
- ISPE Good Practice Guide – Cold Chain Management, 2011.
- PDA: Technical Report 58 – Risk Management for Temperature Controlled Distribution, 2012.
- PIC/S guide to good distribution practice for medicinal products, 2014.
Weitere Informationen
- Französischer Standard AFNOR NFx15-140
- Australischer Standard AS2853-1986
- Deutscher Standard DIN 12880.
- Temperature mapping of storage areas, Technical supplement to WHO Technical Report Series, No. 961, 2011, Annex 9: Model guidance for the storage and transport of time and temperature–sensitive pharmaceutical products, January 2014.
- Qualification of temperature-controlled storage areas, Technical supplement to WHO Technical Report Series, No. 961, 2011, Annex 9: Model guidance for the storage and transport of time and temperature–sensitive pharmaceutical products, January 2014.
Produkte zur Qualifizierung des Umgebungsmappings

Validierungsmappingkit

VaiNet Drahtlos-Temperatur- und Feuchtedatenlogger RFL100

Drahtloser VaiNet-Temperaturdatenlogger RFL100

Temperatur- und Feuchtedatenlogger DL2000