Qualification de cartographie environnementale
Vaisala offre des solutions complètes de cartographie afin de vous permettre de vous conformer aux Bonnes pratiques de distribution (BPD) telles que les BPD UE (2013/C 343/01) et USP 36 chapitre <1079> et le suivant <1083>.
Les cartographies - nécessaires dans les zones où des produits médicaux expérimentaux et à usage humain sont stockés - sont donc réalisées par les fabricants de médicaments, les dépositaires pharmaceutiques, les distributeurs grossistes et autres acteurs de la chaîne d'approvisionnement GxP.
Affichez un échantillon du protocole IQOQ de Vaisala (PDF).
Les offres de Vaisala en matière de cartographie comprennent :
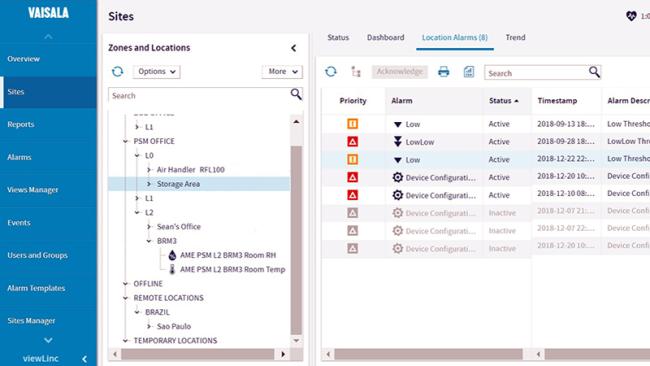
- Kit de cartographie : enregistreurs de données Vaisala et logiciel vLog afin de récupérer les données de mesure et le protocole vLog IQ/OQ afin de valider le logiciel conformément à la réglementation 21 CFR partie 11 et l'annexe 11.
- Services de cartographique de température et d'humidité pour déterminer les dynamiques des réfrigérateurs, congélateurs, chambres froides, entrepôts, zones de stockage, centres de distribution, incubateurs ou chambres de stabilité.
- Remarque : ce service est actuellement proposé en Grande-Bretagne, en Europe et au Japon.
- Points d'étalonnage personnalisé en option pour la meilleure précision de l'industrie
Exigences renforcées en matière de qualification, attentes réglementaires réhaussées
Les bonnes pratiques de distribution ont observé un accent plus important mis sur la réglementation ces dernières années. Ce phénomène a été initié en grande partie par l'agence de réglementation canadienne Health Canada (GUI-0069, 2011), qui fut le premier organisme de réglementation à évoquer la cartographie des températures. De nombreux organismes de réglementation à travers le monde ont bientôt rejoint le mouvement, dont :
- CDSCO (Central Drugs Standard Control Organization, organisme de contrôle des médicaments), Inde
- CFDA (China Food and Drug Administration, agence chinoise des produits alimentaires et médicaments), Chine
- EMA (European Medicines Agency, Agence européenne des médicaments), Europe
Depuis lors, chacune de ces organisations a publié des directives et documents nouveaux ou mis à jour. Les États-Unis ont ensuite actualisé la réglementation USP chapitre <1079> relative aux « Good Distribution Practices for Drug Products » (bonnes pratiques de distribution des médicaments). Peu après, plusieurs guides ont été publiés afin de fournir des instructions spécifiques. La publication de la gestion de la chaîne du froid émise par l'International Society for Pharmaceutical Engineering (Société internationale d'ingénierie pharmaceutique) donne par exemple des conseils sur le positionnement des capteurs lors des cartographies en température. Le rapport technique n°58 de la Parenteral Drug Association (Association des médicaments administrés par voie parentérale) évoque la manière d'évaluer le risque conformément aux BPD. En outre, le PIC/S - Pharmaceutical Inspection Convention and Pharmaceutical Inspection Co-operation Schemes - (ou schéma de coopération dans le domaine de l'inspection pharmaceutique) a publié son propre guide des BPD, très proche des EU GDP. Il s'agissait d'une étape importante en vue de la standardisation mondiale, dans la mesure où le PIC/S compte à ce jour plus de 40 pays participants.
Les changements de l'industrie en matière de chaîne d'approvisionnement à température dirigée entraînent la nécessité de mettre en place des directives
Les activités de distribution évoluent et les chaînes de distribution prennent une dimension de plus en plus internationale. Cette situation a cependant généré un risque accru des écarts de températures. De ce fait, une cartographie bien exécutée représente la méthode idéale pour évaluer et compenser le risque d'écarts. Mais en quoi consiste une cartographie bien exécutée ? Tout d'abord, les études doivent toujours être réalisées avant que les médicaments réglementés ne soient introduits dans une aire de stockage à froid, un entrepôt, une salle ou une chambre à température contrôlée. Les cartographies doivent être effectuées dans des conditions représentatives. Dans la pratique, cela implique que des études cartographiques saisonnières soient menées en hiver et en été. De plus, les cartographies doivent être entreprises en condition de chambre vide et chargée. Une fois les qualifications terminées dans une aire de stockage ou une chambre, des capteurs de surveillance sont positionnés dans les emplacements où les fluctuations de température les plus importantes ont été constatées. Ils sont souvent nommés points chauds et points froids.
Les principes de validation induisent des qualifications fondées sur les objectifs
Les finalités ultimes de la cartographie peuvent être résumées de la manière suivante :
- démontrer l'uniformité de la température (et de l'humidité si nécessaire).
- identifier les zones de stockage inadaptées.
- déterminer les points de surveillance représentatifs.
Il est important de se souvenir que les études de cartographie ne sont pas limitées à des lieux fixes. Dans le cas des véhicules à température contrôlée de la chaîne de distribution, la cartographie initiale des températures est réalisée selon les fondamentaux mentionnés ci-dessus : en conditions représentatives, en charge et à vide, avec des zones exclues de l'espace de stockage ou sous surveillance continue en fonction des résultats de l'étude.
Pour plus d'informations sur les solutions de cartographie de Vaisala, veuillez consulter notre documentation ou contacter votre centre de service local.
Ressources
- EU GDP (2013/C 343/01) Lignes directrices du 5 novembre 2013 sur les bonnes pratiques de distribution des médicaments à usage humain
- USP 36 – Chapitre <1179> Bonnes pratiques de stockage et de distribution des médicaments
- USP 36 – Chapitre <1083> Bonnes pratiques de distribution (mise à jour à venir)
- 21 CRF Part 11 Enregistrements électroniques/signatures électroniques
- EU GMP Annexe 11 Systèmes informatisés
- GUI- 0069 Lignes directrices relatives au contrôle de la température des médicaments pendant le stockage et le transport, 2011.
- CDSCO Lignes directrices relatives aux bonnes pratiques de distribution des produits biologiques, 2012.
- CFDA Les bonnes pratiques d'approvisionnement des produits pharmaceutiques, GSP (Chine) Arrêté N°90 du Ministère de la Santé de la République populaire de Chine, 2013.
- Guide ISPE des bonnes pratiques - Gestion de la chaîne du froid, 2011.
- PDA : rapport technique 58 – Risk Management for Temperature Controlled Distribution (Gestion du risque pour une distribution à température contrôlée), 2012.
- Guide PIC/S des bonnes pratiques de distribution des médicaments, 2014.
Lectures complémentaires
- Norme française, AFNOR NFx15-140
- Norme australienne, AS2853-1986
- Norme allemande, DIN 12880.
- Cartographie de la température des zones de stockage Supplément technique à la série de rapports techniques de l'OMS, N° 961, 2011, Annexe 9 : Modèle pour le stockage et le temps de transport - et produits pharmaceutiques sensibles à la température, janvier 2014.
- Qualification des zones de stockage à température contrôlée, Supplément technique à la série de rapports techniques de l'OMS, N° 961, 2011, Annexe 9 : Modèle pour le stockage et le temps de transport - et produits pharmaceutiques sensibles à la température, janvier 2014.
Produits associés à la qualification en cartographie environnementale

Kit de cartographie de validation

Enregistreur de température sans fil VaiNet RFL100

Enregistreur de données de température et d'humidité sans fil VaiNet RFL100

Enregistreurs de données de température et d'humidité DL2000