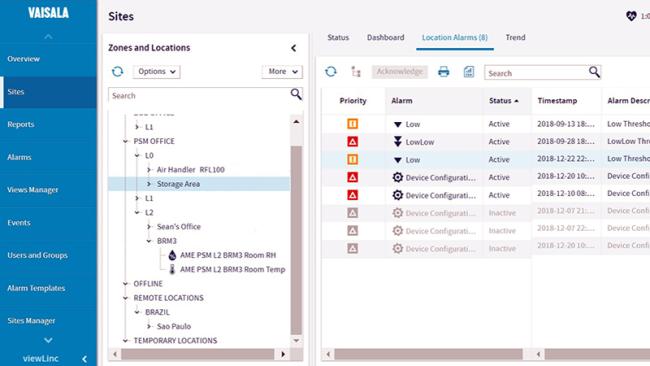
Qualificazione della mappatura ambientale
Vaisala offre soluzioni complete di qualificazione della mappatura per aiutarti a rispettare le normative GDP (Good Distribution Practice) come il GDP dell'Ue (2013/C 343/01) e l'USP 36 Capitolo 1079 e il successivo 1083.
Le qualifiche della mappatura ambientale, necessarie nelle aree che immagazzinano medicinali per uso umano e sperimentale, sono eseguite da produttori di farmaci, strutture di stoccaggio, distributori all'ingrosso e altre parti interessate della catena di approvvigionamento GxP. Si veda un esempio del protocollo IQOQ di Vaisala (PDF).
L'offerta di Vaisala per la qualificazione della mappatura ambientale comprende:
- Kit per mappatura: data logger e software vLog Vaisala per la raccolta dei dati di misurazione e protocollo vLog IQ/OQ per la validazione del software in base alla normativa di cui al titolo 21 del CFR, Parte 11 e Allegato 11
- Servizi di mappatura di temperatura e umidità per determinare le dinamiche ambientali fondamentali di frigoriferi, congelatori, celle frigorifere, magazzini, aree di stoccaggio, centri di distribuzione, incubatori o camere di stabilità.
- Nota: questo servizio è attualmente offerto in Gran Bretagna, Europa e Giappone.
- Punti di di taratura personalizzati opzionali per la massima precisione
Requisiti di qualificazione della mappatura più rigorosi, aspettative normative più elevate
Le buone pratiche di distribuzione hanno visto una maggiore attenzione normativa negli ultimi anni. Ciò è stato in gran parte avviato dall'agenzia di regolamentazione canadese Health Canada (GUI-0069, 2011), che è stato il primo organismo di regolamentazione a menzionare la mappatura della temperatura. Questa direzione è stata presto percorsa anche dagli organismi di regolamentazione di tutto il mondo, tra cui:
- CDSCO (Central Drugs Standard Control Organization), India
- CFDA (China Food and Drug Administration), Cina
- EMA (European Medicines Agency), Europa
Ciascuna di queste organizzazioni da allora ha pubblicato linee guida e documenti nuovi o aggiornati. Gli Stati Uniti hanno quindi aggiornato il capitolo USP 1079 "Buone pratiche di distribuzione per i prodotti farmaceutici". Subito dopo sono state pubblicate diverse guide per offrire istruzioni specifiche. Ad esempio, la pubblicazione sulla gestione della catena del freddo della International Society for Pharmaceutical Engineering fornisce consigli sul posizionamento dei sensori di qualificazione per la mappatura. Il rapporto tecnico 58 della Parenteral Drug Association descrive come eseguire le valutazioni del rischio relative al GDP. Inoltre, il sistema di cooperazione per le ispezioni farmaceutiche ha pubblicato la propria guida GDP, che si allinea strettamente con la regolamentazione delle GDP dell'Ue. Questo è stato un passo importante verso la standardizzazione globale poiché PIC/S ha attualmente più di 40 paesi partecipanti.
Le modifiche del settore relative alla catena di approvvigionamento a temperatura controllata determinano la necessità di chiare indicazioni
Nel frattempo, le attività di distribuzione si sono evolute e le catene di distribuzione sono sempre più internazionali. Tuttavia, ciò ha comportato un aumento del rischio di escursioni termiche. Una qualificazione della mappatura ambientale ben eseguita è il metodo ideale per valutare e compensare il rischio di escursioni. Ma cosa costituisce una qualifica di mappatura ben eseguita? In primo luogo, gli studi dovrebbero essere sempre eseguiti prima che tutti i medicinali regolamentati siano ammessi in un'area di conservazione frigorifera, in un magazzino e in una o più camere a temperatura controllata. Le mappature devono essere eseguite in condizioni rappresentative. In pratica si tratta di studi di mappatura stagionali, invernali ed estivi. Inoltre, le mappature dovrebbero includere condizioni di ambienti a vuoto e a pieno carico. Una volta eseguite le qualifiche di mappatura per un'area o una camera, i sensori di monitoraggio vengono quindi posizionati in base ai luoghi in cui si è verificata la maggior fluttuazione di temperatura, spesso chiamati punti caldi e freddi.
I principi di validazione portano a qualificazioni basate su obiettivi
Gli obiettivi finali della qualificazione della mappatura ambientale possono essere riassunti come segue:
- Dimostrare l'uniformità della temperatura (e dell'umidità, se necessario).
- Identificare aree di stoccaggio non idonee.
- Determinare i punti di monitoraggio rappresentativi
È importante ricordare che gli studi di qualificazione della mappatura non sono limitati a luoghi fissi. Per i veicoli a temperatura controllata nella catena di distribuzione, la qualificazione originale della mappatura della temperatura viene eseguita secondo i fondamenti di cui sopra: in condizioni rappresentative, a vuoto e a pieno carico, con l'esclusione di aree adibite allo stoccaggio o monitorate continuamente in base ai risultati dello studio.
Per ulteriori informazioni sulle soluzioni di qualificazione della mappatura ambientale di Vaisala, consulta la nostra brochure oppure contatta il tuo centro di assistenza locale.
Riferimenti
- EU GDP (2013/C 343/01) Linee guida del 5 novembre 2013 sulle buone pratiche di distribuzione dei medicinali per uso umano
- USP 36 - Capitolo <1179> - Buone pratiche di conservazione e distribuzione dei prodotti farmaceutici
- USP 36 - Capitolo <1083> - Buone pratiche di distribuzione (da rilasciare in futuro)
- 21 CRF Parte 11 - Registri elettronici / firme elettroniche
- GMP UE Allegato 11 - Sistemi computerizzate
- Linee guida GUI- 0069 per il controllo della temperatura dei prodotti farmaceutici durante lo stoccaggio e il trasporto, 2011.
- Linee guida CDSCO sulle buone pratiche di distribuzione per i prodotti biologici, 2012.
- CFDA - Buone pratiche di distribuzione dei prodotti farmaceutici, GSP (Cina) - Decreto del Ministro della Salute della Repubblica Popolare Cinese n. 90, 2012.
- Guida sulle buone pratiche dell'ISPE - Gestione della catena del freddo, 2011.
- PDA: Rapporto tecnico 58 - Gestione dei rischi per la distribuzione a temperatura controllata, 2012.
- Guida PIC/S alle buone pratiche di distribuzione dei medicinali, 2014.
Ulteriori riferimenti
- Standard francese, AFNOR NFx15-140
- Standard australiano, AS2853-1986
- Standard tedesco, DIN 12880.
- Mappatura della temperatura delle aree di stoccaggio, supplemento tecnico alla serie di relazioni tecniche dell'OMS, n. 961, 2011, allegato 9: guida del modello per lo stoccaggio e il trasporto di prodotti farmaceutici sensibili al tempo e alla temperatura, gennaio 2014
- Qualificazione delle aree di stoccaggio a temperatura controllata, supplemento tecnico alla serie di relazioni tecniche dell'OMS, n. 961, 2011, allegato 9: guida del modello per lo stoccaggio e il trasporto di prodotti farmaceutici sensibili al tempo e alla temperatura, gennaio 2014
Prodotti correlati alla qualificazione della mappatura ambientale

Kit di mappatura validazione

Data logger per temperatura wireless VaiNet RFL100

Data logger per temperatura e umidità wireless VaiNet RFL100

Data logger di temperatura e umidità DL2000