如何测量二氧化碳 (CO₂)

很多应用领域(从建筑自动化和 温室到生命科学和人身安全)都 需要进行二氧化碳测量。
本文档涉及以下主题:
红外传感器的操作原理
二氧化碳和由两个或更多不同原子组成的 其他气体以独特的方式吸收红外线 (IR) 辐射。可使用 IR 技术检测这类气体。例 如,可使用 IR 传感器测量水蒸汽、甲烷、 二氧化碳和一氧化碳的含量。其特征吸收 谱带显示在图 1 中。
IR 传感是应用广泛的一种 CO2 检测技 术。IR 传感器与化学传感器相比有很多 优势。它们稳定,且对于测量的气体具 有高选择性。它们的使用寿命长,因为 测量的气体不直接与传感器作用,IR 传 感器可以承受高湿度、灰尘、脏污和其 他恶劣环境。
IR CO2 检测器的核心部件是光源、测量 室、干扰滤波器和 IR 检测器。IR 辐射从 光源通过测量的气体导向到检测器。位于 检测器前面的滤波器防止非测量气体特有 的波长抵达检测器。检测光强度并将其转 换为气体浓度值。
维萨拉 CARBOCAP® 二氧化碳传感器 使用 IR 红外传感技术来测量 CO2 的 体积浓度。它采用独特的电可调法布里珀罗干涉仪 (FPI) 滤波器进行双波长 测量。这意味着除了测量 CO2 吸收量 外,CARBOCAP® 传感器还执行参考测 量,该测量可补偿光源强度的变化以及 光路中的污染和污垢积聚。这使传感器 随着时间的推移也非常稳定。有关用于 CO2 测量的所有维萨拉产品系列,请访 问:www.vaisala.com/CO2

图 1. CO2 和一些其他气体的 IR 吸收量
理想气体定律
当估计温度和压力变化对 CO2 测量的影 响时,理想气体定律很有用。它可用于补 偿 CO2 读数。
理想气体是一种假想气体,它们由随机移 动的相同点粒子组成,其大小和分子间相 互作用力可忽略不计。假定理想气体分子 相互之间以及与容器壁均发生弹性碰撞。
在现实世界中,气体的行为并不与理想气 体的行为完全相同,但是理想气体的行为 常常可用于描述实际气体的近似行为。理 想气体定律根据下面的方程式来描述一 定量气体的状态与压力、体积和温度之间 的关系:
pV = nRT
其中
p = 压力 [Pa]
V = 气体体积 [m3]
n = 气体量 [mol]
R = 通用气体常数 (= 8.3145 J/mol K)
T = 温度 [K]

图 2. 维萨拉 CARBOCAP® CO2 传感 器的结构
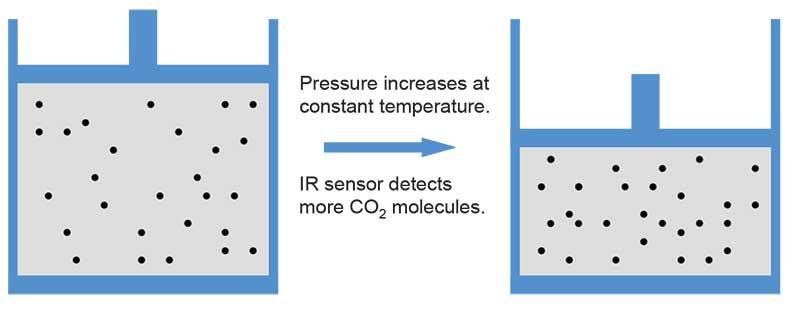
恒温时压力增加
恒压时温度增加

CO₂ 变送器的最佳位置
- 避免放在人呼吸的气体可能会直接传到传感器的位置。还要避免将传感器靠近进气或排气管,也不要靠近窗口和门口。
- 墙上安装的传感器(按需通风)与管道安装的传感器相比,可提供有关通风效果的更准确数据。管道安装的传感器更适合 单区域系统,应尽可能靠近被占用的空间,以便于维护。
- 出于人身安全目的测量 CO2 时,变送器应靠近潜在的泄漏点安装,以便提早检测。需要考虑监测区域的几何形状、通风和 气流情况。应基于风险评估确定 CO2 变送器的数目和位置。
温度和压力对 CO₂ 测量的影响
大多数气体传感器发出的信号与分子密度 (单位气体体积的分子数)成正比,即使 读数用 ppm(百万分率,体积/体积)表 示。压力和/或温度变化时,气体的分子密 度根据理想气体定律发生相应变化。该影 响通过传感器的 ppm 读数可以看到。
下图直观地说明压力或温度增加如何改 变气体状态以及它如何影响 CO2 测量。
理想气体定律可用于计算给定温度和压力 下气体的分子密度,此时标准环境温度和 压力 (SATP) 条件下的气体密度是已知 的。将气体量 (n) 替换为 ρV/M,假定气 体的摩尔质量 (M) 在两个不同条件下为 常数,则方程式可以表示为:方程式 1。

其中
ρ = 气体体积浓度 [ppm 或 %]
p = 环境压力 [hPa]
t = 环境温度 [°C]
方程式 1. 给定温度和压力下气体浓度的计算
密度公式可用于估计当温度和/或压力变 化时气体传感器读数如何变化。
密度公式可用于补偿测量 CO2 时的温度 和压力变动。普通 CO2 仪表不测量压力, 因此无法自动补偿压力变动。在工厂校 准时,通常将仪表设置为海平面压力条件 (1013 hPa)。在海拔不为海平面的高度进 行测量时,建议补偿压力影响。这可以通 过以下方式实现:输入用于内部补偿的正 确压力设置(恒压条件)或将补偿编程到 自动化系统或 PC(变化的压力条件)。
同样的补偿规则适用于温度影响。不过, 现在提供了很多可测量和补偿温度变动的 CO2 计,因此无需任何外部补偿。
表 1 显示根据理想气体定律,当温度和 压力变化时 CO2 传感器读数(气体在 SATP 下包含 1,000 ppm 的 CO2 )如 何变化的示例。
| 温度 (°C) | ||||||||||
| 压力 (hPa) | -20 | -10 | 0 | 10 | 20 | 25 | 30 | 40 | 50 | 60 |
| 700 | 814 | 783 | 754 | 728 | 703 | 691 | 680 | 658 | 638 | 618 |
| 800 | 930 | 895 | 862 | 832 | 803 | 790 | 777 | 752 | 729 | 707 |
| 900 | 1046 | 1007 | 970 | 936 | 904 | 888 | 874 | 846 | 820 | 795 |
| 1000 | 1163 | 1119 | 1078 | 1039 | 1004 | 987 | 971 | 940 | 911 | 883 |
| 1013 | 1178 | 1133 | 1092 | 1053 | 1017 | 1000 | 983 | 952 | 923 | 895 |
| 1100 | 1279 | 1230 | 1185 | 1143 | 1104 | 1086 | 1068 | 1034 | 1002 | 972 |
| 1200 | 1395 | 1342 | 1293 | 1247 | 1205 | 1185 | 1165 | 1128 | 1093 | 1060 |
| 1300 | 1512 | 1454 | 1401 | 1351 | 1305 | 1283 | 1262 | 1222 | 1184 | 1148 |
表 1. 在不同温度和压力条件下测量具有 1,000 ppm 浓度的气体时 CO2 传感器的 ppm 读数
潮湿气体样本的干燥
进一步处理理想气体定律使我们可以了解 气体混合物的组成在恒定压力、温度和体 积时如何变化。例如,这可用于估计湿度 变化对 CO2 读数的影响。
气体混合物的分子存在于在相同温度下 的相同系统体积中(V 对于所有气体均相 同)。理想气体定律可以改为:

其中
ngas1 = 气体 1 的量 [mol]
ngas2 = 气体 2 的量 [mol] 等等
并且

其中
p = 气体混合物的总压
pgas1 = 气体 1 的分压
pgas2 = 气体 2 的分压等等
第二个方程式称为道尔顿分压定律。它指 定气体混合物的总压等于混合物中所有组 分气体的分压之和。
当考虑水蒸汽对 CO2 传感器读数的影响 时,此信息很有用。如果在压力、温度和 体积不变时将水蒸汽加到干燥气体,水将 替代混合物中的某些气体分子。同样,如 果从高湿环境下提取某个气体样本并在 进入 CO2 计的测量室前允许干燥,则水 分子的流失会改变气体的组成,从而影响 CO2 测量。
这被称为稀释效应,可以使用表 2 来估 计。已知干燥气体的 CO2 浓度时可以计 算高湿环境下的 CO2 浓度。为此,需要知 道 1013 hPa 下的露点 (Td) 或干湿条件 下的水蒸汽浓度 (ppm)。从横轴选择高 湿环境的湿度条件,从纵轴选择干燥气体 的条件。
示例:从露点为 40°C(水含量为 73,000 ppm)的环境提取一个气体 样本,将其放入 20°C Td (水含量为 23,200 ppm)的环境。测量的 CO2 浓 度 5.263%(20°C Td 下)转换为 40°C Td 环境下的 5.00% (5.263% × 0.950 = 5.00%)。读数变小是 40°C Td 下更高 的水含量稀释导致的。
| Td(°C) | -40 | -30 | -20 | -10 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
| Td(°C) | ppm H2O | 127 | 377 | 1 020 | 2 580 | 6 060 | 12 200 | 23 200 | 42 000 | 73 000 | 122 000 | 197 000 |
| -60 | 11 | 0.9999 | 0.9996 | 0.999 | 0.997 | 0.994 | 0.988 | 0.977 | 0.958 | 0.927 | 0.878 | 0.803 |
| -50 | 39 | 0.9999 | 0.9997 | 0.999 | 0.997 | 0.994 | 0.988 | 0.977 | 0.958 | 0.927 | 0.878 | 0.803 |
| -40 | 127 | 1.0000 | 0.9997 | 0.999 | 0.998 | 0.994 | 0.988 | 0.977 | 0.958 | 0.927 | 0.878 | 0.803 |
| -30 | 377 | 1.0000 | 0.999 | 0.998 | 0.994 | 0.988 | 0.977 | 0.958 | 0.927 | 0.878 | 0.803 | |
| -20 | 1 020 | 1.000 | 0.998 | 0.995 | 0.989 | 0.978 | 0.959 | 0.928 | 0.879 | 0.804 | ||
| -10 | 2 580 | 1.000 | 0.997 | 0.990 | 0.979 | 0.961 | 0.930 | 0.880 | 0.805 | |||
| 0 | 6 050 | 1.000 | 0.994 | 0.983 | 0.964 | 0.933 | 0.884 | 0.809 | ||||
| 10 | 12 200 | 1.000 | 0.989 | 0.970 | 0.939 | 0.890 | 0.815 | |||||
| 20 | 23 200 | 1.000 | 0.981 | 0.950 | 0.901 | 0.826 | ||||||
| 30 | 42 000 | 1.000 | 0.969 | 0.920 | 0.845 | |||||||
| 40 | 73 000 | 1.000 | 0.951 | 0.876 | ||||||||
| 50 | 122 000 | 1.000 | 0.925 | |||||||||
| 60 | 197 000 | 1.000 |
表 2. 气体样本干燥的稀释系数
二氧化碳和人身安全
不同 CO2 浓度水平的影响 | |
| 浓度 | 影响 |
| 350 - 450 ppm | 通常的大气浓度 |
| 600 - 800 ppm | 可接受的室内空气质量 |
| 1,000 ppm | 可忍受的室内空气质量 |
| 5,000 ppm | 要求平均暴露时间不超过 8 小时 |
| 6,000 - 30,000 ppm | 要小心了,只能短时间暴露 |
| 3 - 8% | 呼吸急促,头疼 |
| > 10% | 恶心、呕吐、昏迷 |
| > 20% | 很快昏迷、死亡 |
二氧化碳是无毒性的不可燃气体。但是,暴露在高浓度二氧化碳的环境中可能导致生命危险。无论何时使用、生产、装运或 存储 CO2 气体或干冰,CO2 浓度都可能上升到危险的高水平。由于 CO2 无色无味,因此无法检测到泄露,这意味着需要正 确的传感器来帮助确保人身安全。