アプリケーションノート
土壌・雪・水生生態系計測における平衡サンプリング

土壌・雪・水生環境におけるCO₂濃度およびCO₂フラックス計測手法の概要
陸域生態学において、土壌CO₂フラックスは通常チャンバー法で計測され、地表と大気間のCO₂交換において重要な役割を果たしています。近年では、土壌内部および土壌と大気間のCO₂輸送を調べるために、CO₂濃度勾配法が広く用いられるようになっています[1, 2, 3]。土壌内で生成されたCO₂は、主に拡散によって土壌層間および土壌から大気へと輸送されます。CO₂フラックスは、土壌層内および土壌と大気間の濃度勾配から算出することができます。この勾配法は、土壌内におけるCO₂生成の鉛直分布や、CO₂フラックスに影響を与えるプロセスの研究に特に適しています。
冬季には、北極圏や亜寒帯地域で数か月にわたる積雪があるため、土壌CO₂フラックスの連続的なチャンバー計測は困難です。CO₂濃度勾配から雪層を通じたCO₂の拡散量を算出することで、冬季のCO₂フラックス計測においてチャンバー法の代替手段となります[4, 5]。雪および土壌での計測においては同じ原理が適用され、すなわち拡散特性がCO₂の雪や土壌を通じた拡散速度を決定します。
水生生態学においては、溶存CO₂(例:pCO₂)の計測は、水–大気間のCO₂移動量の推定や水生生物群集の代謝速度の算出において重要な役割を果たします。溶存CO₂量はアルカリ度、pH、溶存無機炭素から算出することも可能ですが(例:[6])、分析誤差を最小限に抑えるためにはpCO₂の直接計測が推奨されます。pCO₂を直接計測する最も一般的な方法はヘッドスペース平衡法であり、水試料をヘッドスペースガスと平衡させ、そのガス中のCO₂濃度を赤外線ガス分析計やガスクロマトグラフィーで分析します[7]。pCO₂の計測と同時に水温を計測することで、ヘンリーの法則を適用して溶存CO₂量を量を算出できます(例:[6])。
水生システムではCO₂濃度が時間的に大きく変動することがあります。高い一次生産(すなわちCO₂消費量が多い)期間は短く、ヘッドスペース法で追跡するのは困難で手間がかかります。従来の代謝プロセスの計測は、水生生物群集を小瓶に封入し、数時間インキュベートした後にガス濃度や取り込まれた炭素量の変化を計測する方法が用いられてきました[8]。しかし、封入された小瓶内の条件は自然環境とは異なるため、これらの方法は誤った結果をもたらす可能性があります[8, 9]。自由水中でのin situでの代謝ガスのモニタリングは、一次生産や群集呼吸など生態学的に重要なプロセスをより信頼性高く推定する手法です。
ここでは、高い時間分解能でCO₂を連続モニタリングできる新しいシステムを紹介します。この新しい平衡サンプリング法は、CO₂アナライザー(ヴァイサラ CARBOCAP® 二酸化炭素プローブ GMP343、ポンプ、ガス不透過性配管、および計測対象とシステム間でガス交換を可能にする半透過性チューブからなる閉回路内で空気を循環させる仕組みです。半透過性チューブは水やその他の計測対象媒体に設置されます。チューブ内の空気はポンプで循環され、ループ内のガス濃度はシステム外部のガス濃度と平衡に達します。この拡散駆動型システムの応答時間は、ガス透過膜の特性および平衡化表面積とループ全体積の比率に依存します。
平衡サンプリングのための機器設置
平衡サンプリングのための一般的な計測セットアップでは、土壌や水生生態系における関心のある鉛直方向のCO₂勾配全体をカバーするため、複数のGMP343プローブを使用します。計測ユニットは、GMP343、リニアポンプ(SMG4、12VDC、Rietschle Thomas AB、流量1.1 L/min)、およびガス不透過部として用いるステンレススチール配管(継ぎ目なしAISI 316L、8 x 1.0 mm)とブチルゴム(Saint Germain IR 00022、6 x 12 mm、VWR International)製チューブで構成されます(図1参照)。
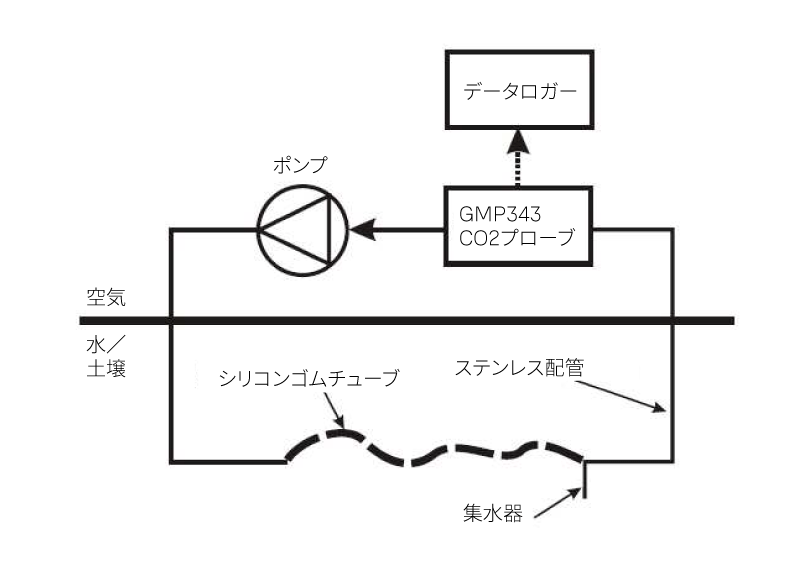
システムの半透過性部分は、内径6 x 1.5 mmのシリコンゴムチューブ(Rotilabo® Art:9572.1, Roth GmbH)で構成されており、外部からの圧力によるチューブのつぶれを防ぐために、チューブ内部にステンレス製コイルスプリング(RST 0.5 x 5 x 1 000 mm)が挿入されています(図2参照)。シリコンゴムを通して水蒸気を含むガスが拡散するため、T字ジョイント(Svagelok, Helsinki Valve & Fitting Oy, フィンランド)で接続した上昇用ステンレス配管の下端に、デッドエンド型のステンレス配管を追加して水分を回収することが推奨されます。
各計測深度には温度プローブ(Philips KTY81-110, Philips Semiconductors)が設置されています。ここではアナログ出力オプション(0~5V出力信号)を用い、A/Dコンバータ(Nokeval Oyj, フィンランド)でアナログ信号をデジタル値に変換し、コンピュータで記録します。GMP343プローブとポンプは耐候性の設置ボックス内に配置されます(図2参照)。

平衡サンプリング用ガスコレクターの応答時間の算出
シリコンゴムチューブの応答時間を空気中または水中で確認するには、テストが必要です。水中でのテストは、シリコンゴムループ内に高濃度のCO₂スパンガス(例:5,160 ppm)を充填し、周囲の水を約400 ppmのCO₂濃度を持つ外気と平衡になるまでバブリングすることで実施できます。空気中でのテストは、一定のCO₂濃度を保ったステンレス製タンク内で行います。
高濃度のCO₂スパンガス(例:4,500 ppm)で満たしたループを、約400 ppmのCO₂濃度を持つ外気で囲み、チューブ内のCO₂濃度を時間経過に従ってモニタリングします。
シリシリコンゴムチューブの長さやチューブ壁の厚さがCO₂拡散に与える影響は図2に示しています。チューブの長さを長くし、壁の厚さを薄くすることで、応答時間をわずかに短縮できます。CO₂濃度変化の速度は一次指数減衰関数に従い、その半減期は表1に示します。
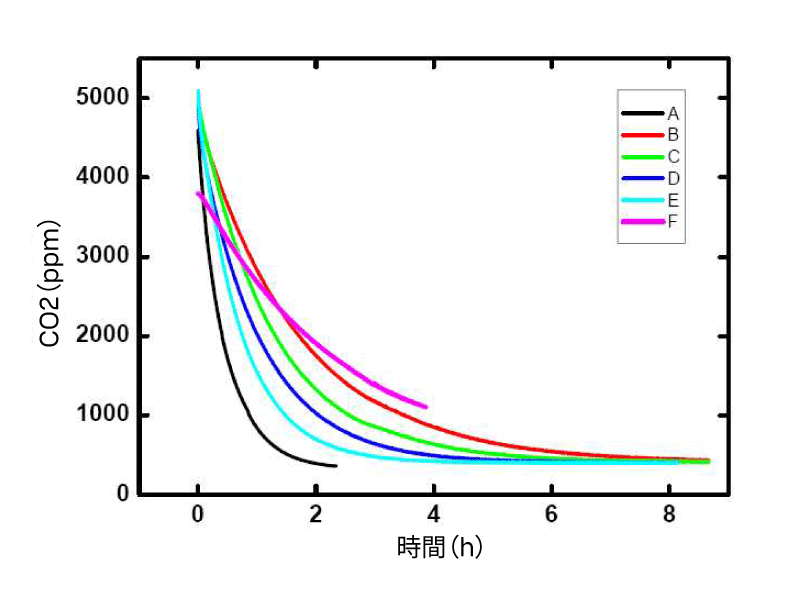
表1.テストされたガスコレクター材料の半減期(A~Fは図2の凡例を参照)
| ガスコレクター材料 | t1/2(時間) | ||
| 水 | 空気 | ||
| シリコンゴム | 1メートル 6/1.5 mm | 1.18 (B) | 1.67 (F) |
| 1メートル 5/1.0 mm | 0.87 (C) | ||
| 2メートル 6/1.5 mm | 0.72 (D) | ||
| 2メートル 5/1.0 mm | 0.51 (E) | ||
| 焼結PTFE | 0.32 (A) | ||
シリコンゴムと比較すると、焼結PTFEチャンバー(長さ123 mm、直径32.5 mm、図3参照)は、より速い応答時間を示しました。したがって、焼結PTFEはガスコレクター材料として有望です。

土壌・積雪中の平衡サンプリング
平衡サンプリング法は、土壌プロファイル内のCO₂濃度計測に利用できます。ここでは、土壌ピットの垂直面における4つの深度(2、7、12、22 cm)での設置例を紹介します。CO₂濃度に加え、土壌拡散率を算出するためには土壌温度および含水率のデータも必要です。
土壌の拡散率およびその正確な決定は、勾配法によって得られるCO₂フラックス値において極めて重要な役割を果たします。土壌中のCO₂拡散率は、土壌全体の空隙率、曲がりくねり度(トーチュオシティ)、含水率、輸送距離に依存します。これらの変数は、正確なフラックス計算のために各土壌層ごとに個別に決定する必要があります。土壌拡散率の推定には、ラドンなどのトレーサーガスを用いる方法もありますが、トレーサー法では土壌の平均拡散率しか得られないため、CO₂濃度とともに土壌含水率を継続的にモニタリングすることが推奨されます。
平衡サンプリング法で計測された土壌および積雪中のCO₂濃度は、明確な季節変動パターンを示します(図4)。CO₂濃度は土壌深度が深くなるにつれて増加します。また、春先に雪が融けて土壌の含水率が上昇すると、すべての層でCO₂濃度が増加します。融解期間中の計測の中断は、土壌水分がシステム内に流入したことによるものです。
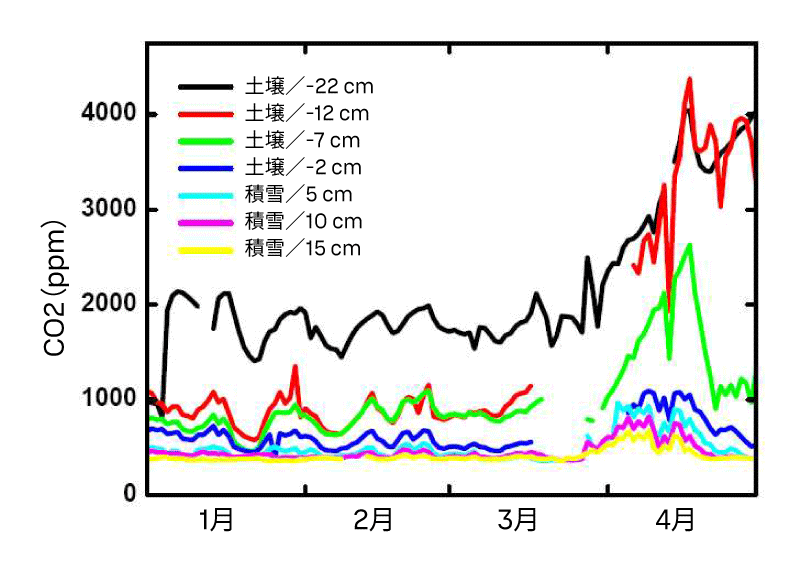
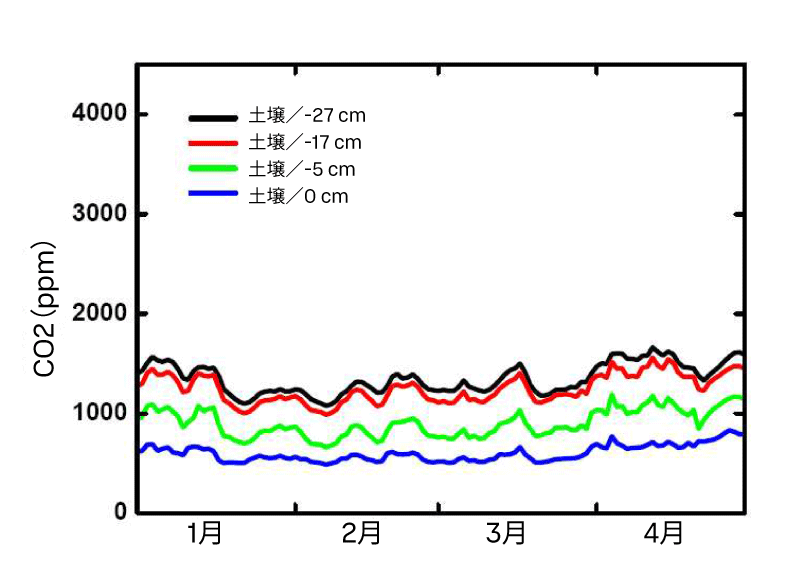
比較のために、GMP343プローブは土壌CO₂プロファイル計測において3年間連続して使用されてきました。0、5、17 cmの深度に埋設したプローブは、1月から3月の期間において平衡サンプリング法と同等の結果を示しています(図4および図5)。4月以降は、平衡サンプリング法の値が高くなっていますが、これはおそらく土壌含水率の上昇によるものと考えられます。
水生生態系における平衡サンプリング
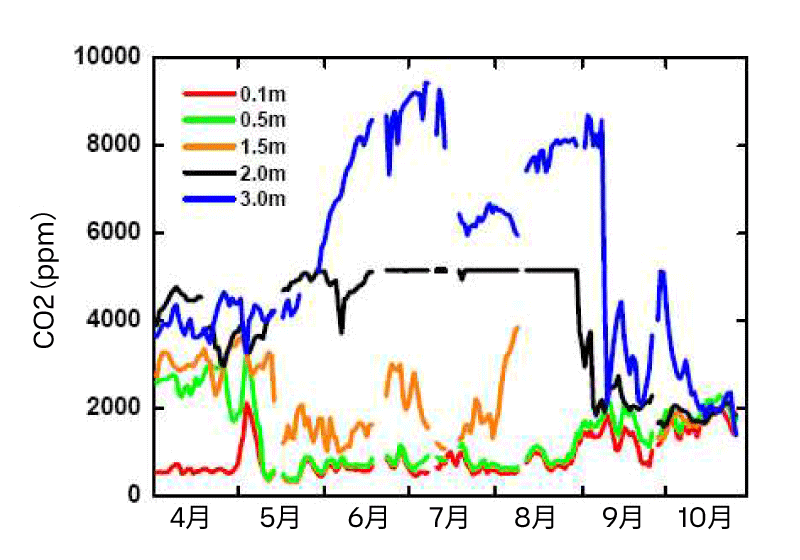
土壌や積雪の研究に加えて、平衡サンプリング法は水生生態系におけるCO₂プロファイルの調査にも利用できます。GMP343プローブは、断熱・耐水性のボックスに収納し、浮遊プラットフォーム上に設置できます(図6参照)。ガスコレクター用チューブは、水中のさまざまな深度(ここでは0.1、0.5、1.5、2.0、3.0 m)に設置されます。

CO₂計測は、開水面期間を通して実施できます(図7)。光合成に関する情報を得るため、0.5 mの深度で水柱内の光量子束密度(PFD, µmol m⁻²s⁻¹)も同時に計測されます。湖内のガスコレクター用シリコンゴムチューブは、バイオファウリングおよびそのCO₂濃度データへの影響を防ぐため、月に一度交換されます。同時にウォーターコレクターも排水されます。
開発された計測システムは高い信頼性を示しています。ポンプの故障が一部発生したものの、この方法により開水面期間中の水中鉛直CO₂プロファイルの連続計測が可能です。CO₂濃度は主に鉛直勾配を示し(図7)、表層水は大気とほぼ平衡状態にあり、3 mの深度では最大で約10,000 ppmという高いCO₂濃度が観測されました。2 mの深度では、夏季にGMP343の計測範囲(0~5,000 ppm)を超えるCO₂濃度が記録されました。10月には表層から底層までの水柱全体が完全に混合されている様子が見られた一方、春季の混合は不完全であることが示唆されます(図7)。
※販売終了製品
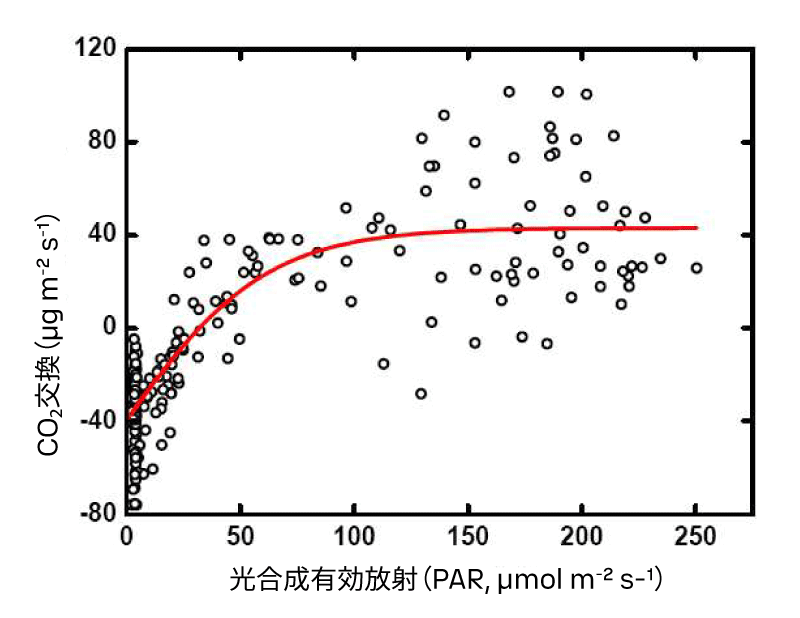
高時間分解能で収集されたデータは、CO₂の消費および生成が環境要因に依存する関係をモデル化し、群集代謝速度、すなわち一次生産および群集呼吸速度を算出するために利用できます[10]。光合成有効層における30分間のCO₂消費量または生成量を計算し、交換速度に対してPlatt-Jassby型の光依存性曲線(いわゆるP-I曲線)[11]を当てはめることができます(図8)。この方法は、従来の実験室や船上での計測と比べて新しい手法であり、従来法では得られるデータセットがかなり限定的であることが多いです。
水生環境での計測アプリケーション
湖沼環境で1年間計測を行った経験から、以下の点が明らかになりました。
- 固体表面は水生付着生物の生育基盤となるため、自然水域での長期計測ではバイオファウリングが大きな問題となることが多いです。付着藻類の増殖は、ガスコレクターを遮光性材料で覆うことで防ぐことができますが、これだけでは表面の細菌増殖を防ぐことはできません。しかし、有害な防汚化学薬品の使用は推奨されません。ガス交換へのバイオファウリングの悪影響を避けるためには、ガスコレクターを定期的に清掃または交換する必要があります。
- 本システムによる計測は、水域の表層水に限定されます。長いチューブの取り扱いは不便であり、複雑かつやや危険です。深水域での計測には、全機器を防水ケースに収め、計測深度まで沈める必要があります。
- 生産性が低い時期には、応答時間が遅いために本システムの感度が十分でないことがありました。この問題は、例えば焼結PTFE材料を用いることで応答時間を改善することで解決できます。循環空気を100本の細いシリコンゴムチューブに分岐させたガスコレクターでは、非常に優れた応答時間が得られています[12, 13]。しかし、このようなガスコレクターシステムを水密化することは困難であり、メンテナンスも難しい場合があります。したがって、ガスコレクターシステムはできるだけシンプルに保ち、材料の最適化によって応答時間を改善することが推奨されます。
平衡サンプリングシステムにおけるGMP343の性能
GMP343トランスミッターの精度および再現性は、計測値を1分間平均した場合、土壌プロファイルのCO₂計測に十分適しています。GMP343は耐湿性および耐腐食性に優れており、2004年6月以降、森林土壌の0 cm、5 cm、17 cm、27 cmの深度に設置されています。この土壌は表層でpH 3.5~4、深層でpH 4~5と、比較的酸性度が高い環境です。土壌の体積含水率は年間を通じて20~30%、秋季および雪解け時には30~40%でした。これらの比較的厳しい条件下でも、プローブは年間を通じて問題なく稼働しています。埋設したトランスミッターには焼結PTFEフィルターキャップと改良型キャリブレーションアダプターが装着されており、プローブの光学部への結露を防ぐためにGMP343の加熱オプションが有効化されています。
ただし、GMP343を土壌中に埋設する場合、加熱オプションの使用には注意が必要です。わずかな加熱でもプローブ周辺の土壌温度に影響を及ぼす可能性があります。例えば、加熱の影響でプローブ周辺の雪が他よりも早く融けることがあり、この「早い春」によってプローブ周辺の土壌条件が変化する可能性があります。しかし、土壌深部では熱が拡散するため、加熱の影響はそれほど大きくありません。これは土壌の熱伝導率にも依存します。プローブ近傍(約1 cm)および同深度で離れた場所の土壌温度をモニタリングし、加熱の影響を把握することが望ましいです。
計測範囲0~5,000 ppmは、生育期の土壌CO₂プロファイル計測には狭すぎる場合があります。本研究では約20~30 cmの深度でCO₂濃度を計測しましたが、より深い層ではCO₂濃度が20,000 ppmに達することもあるため、プローブの計測範囲は想定される最大濃度に応じて選択する必要があります。
参考文献
[1] Tang, J., Baldocchi, D.D., Qi, Y. and Xu, L. 2003. Assessing soil CO2 efflux using continuous measurements of CO2 profiles in soils with small solidstate sensors. Agr. Forest Meteorol. Meteorology 118 (3-4): 207–220.
[2] Jassal, R. S., Black, T. A., Drewitt, M. D., Novak, M. D., Gaumont-Guay, D. and Nesic, Z. 2004. A model of the production and transport of CO2 in soil: predicting soil CO2 concentrations and CO2 efflux from a forest floor. Agr. Forest Meteorol. 124: 219–236.
[3] Pumpanen, J., Ilvesniemi, H., Kulmala, L., Siivola, E., Laakso, H., Kolari, P., Helenelund, C., Laakso, M., Uusimaa, M., Iisakkala, P., Räisänen, J. and Hari, P. Role of recent photosynthate in CO2 efflux from boreal forest soil as determined from soil air CO2 concentration profiles. Submitted to Global Change Biol.
[4] Sommerfield, R. A., Mosier, A. R. and Musselman, R. C. 1993. CO2, CH4 and N2O flux through a Wyoming snowpack and implications for global budgets. Nature 361: 140–142.
[5] Fahnestock, J.T., Jones, M.H., Brooks, P.D., Walker, D.A. and Welker, J.M. 1998. Winter and early spring CO2 efflux from tundra communities of northern Alaska. J. Geophy. Res. 103(D22): 29023–29027.
[6] Stumm, W. and Morgan J. J. 1970. Aquatic Chemistry. Wiley-Interscience.
[7] McAuliffe, C. C. 1971. GC determination of solutes by multiple phase equilibration. Chem. Technol. 1: 46–51.
[8] Peterson, B. J. 1980. Aquatic primary productivity and the 14C-CO2 method: A history of the productivity problem. Ann. Rev. Ecol. Sys. 11: 359–385.
[9] del Giorgio, G. and Williams, P. J. le B. [eds.] 2006, Respiration in aquatic ecosystems. Oxford University Press.
[10] Hari, P., Pumpanen, Huotari, J., J. Kolari, P., Grace, J., Vesala, T. and Ojala, A. High-frequency measurements of photosynthesis of planktonic algae using rugged nondispersive infrared carbon dioxide probes. Submitted to Limnol. Oceanogr.: Methods.
[11] Platt, T. and Jassby, A. D. 1976. The relationship between photosynthesis and light for natural assemblages of coastal marine phytoplankton. J. Phycol. 12: 421–430.
[12] Carignan, R. 1998. Automated determination of carbon dioxide, oxygen and nitrogen partial pressures in surface waters. Limnol. Oceanogr. 43: 969–975.
[13] Hanson, P. C., Bade, D. L., Carpenter, S. R. and Kratz, T. K. 2003. Lake metabolism: Relationships with dissolved organic carbon and phosphorus. Limnol. Oceanogr. 48: 1112–1119.